Mickaël TANTER - 神经科学中的超声:从功能成像到读写脑机接口
撰稿:谢冕 审核:陈良怡
2024年10月16日下午,受北京大学麦戈文脑研究所陈良怡教授邀请,巴黎高等物理化工学院(ESPCI Paris)的Mickaël TANTER教授在金光生命科学大楼邓祐才报告厅带来一场题为“Ultrasound in Neuroscience: from Functional lmaging to Read/Write Brain Machine Interfaces”的精彩报告。

Mickaël TANTER教授做报告与交流
- 超快超声成像将传统超声成像速度提高了约200倍
2002年,Tanter教授及其团队报告了第一台超快速成像系统1,2,区别于传统方法使用聚焦波,多次改变延迟,多次传输获取一维图像并进行拼接,超快超声成像发送平面波,并将来自介质各处的反向散射解码记录到内存中,只经过一次传输,通过算法生成图像(图1)。和传统方式相比,超快超声成像的帧频从每秒50帧提高到了每秒10000帧,提高了约200倍。
基于此,更多有趣的现象可以被观测,包括机械剪切波、肌纤维收缩以及血流,它们都是以m/s为单位的,如果你想看到它们每毫米的变化,就需要每毫秒拍摄一张图像,这就是需要超快速成像的原因。举个例子,通过测量剪切波速可以绘制出器官的硬度图,癌症病灶内部的硬度与周围组织的硬度相差50倍,这对于乳腺癌、肝癌、甲状腺癌和前列腺癌的诊断是一个很好的补充。此外,通过超快速成像,还能看到心肌的收缩、颈动脉分叉处的湍流等。

图1,传统超声和超快超声对比
- 功能超声成像可用于各种神经科学应用,包括绘制大脑活动图、研究功能连接以及潜在的脑机接口。
从2008年开始,Tanter团队决定不再只研究机械波,而是研究流动,也就是研究多普勒信号。事实上,在传统的多普勒技术中,我们就可以对大血管中的血流进行成像。这里展示了一名志愿者的甲状腺(图2),相对于传统的多普勒技术,超快多普勒成像的灵敏度提高了近50倍,小血管中的慢速血流得以被看见3。这似乎很矛盾,我们需要用超快速来观察慢速流动的东西,但解释起来却很简单,当我们想对小血管中的慢速血流进行成像时,最大的问题是很难将慢速血流与组织的运动分开,因此,需要超快的速度来获得大量数据,以便能够对运动进行分离。

图2,传统多普勒和超快多普勒对比
基于此,Tanter团队开发了功能超声(fUS),类似于功能性磁共振成像(fMRI),使用fUS可以测量血容量从而间接获取信息。fMRI具有出色的深度穿透性,但不能提供良好的空间和时间分辨率,难以应对复杂的瞬态事件(如癫痫发作),而fUS则具有高时空分辨率以响应大脑活动。
Tanter团队利用fUS识别大脑激活区域,对胡须诱发的皮质和丘脑反应以及癫痫发作在大鼠大脑中的传播进行成像4(图3)。我们知道,老鼠的每根胡须都对应着桶状皮层部分,在实际记录中,胡须一旦被刺激,桶状皮层的血容量就会增加,甚至是动态持续的增加。值得注意的是,fUS的分辨率达到100 μm,已经比fMRI的分辨率更高,并且其灵敏度非常高,相比于fMRI测量的2%或3%的变化率,fUS成像可以达到20%到30%的变化率。
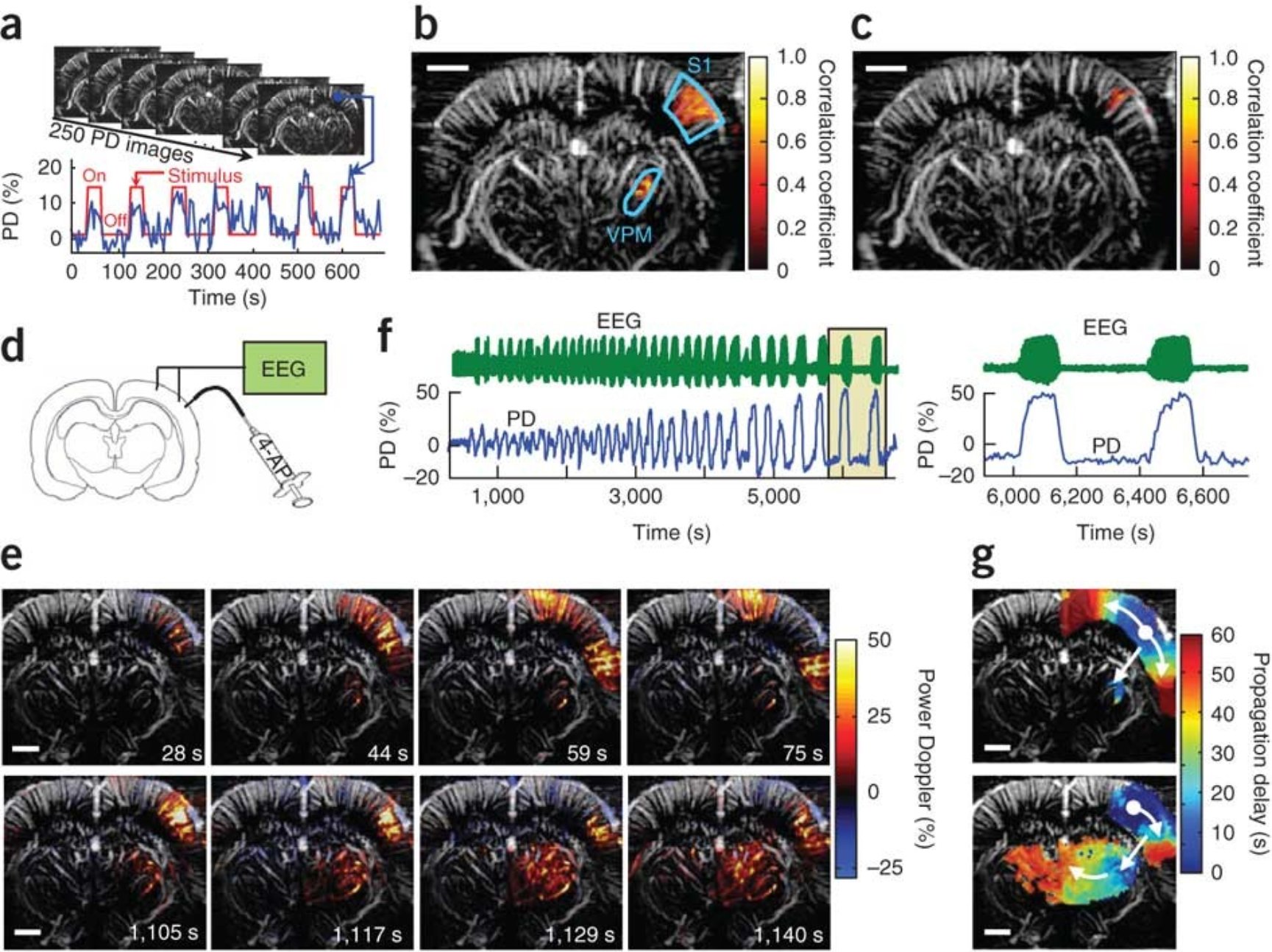
图3,fUS成像的应用,胡须刺激(a-c)及癫痫模型(d-g)
此外,Tanter教授及其合作团队还进行了许多其他实验,例如研究大鼠的视觉系统5、大鼠角膜疼痛模型下三叉神经的激活6、雪貂的听觉系统、小鼠的大脑功能连接7等。从2013年开始,Tanter团队还绘制了大鼠或小鼠大脑的3D血管图和功能图谱,利用这项工作,可以实现在所有大脑尺度上进行三维超声成像和功能连接分析。
fUS的另一个有趣之处在于,与fMRI相比,它不需要将动物放入fMRI系统中,而可以真正实现系统的微型化。在过去的十年中,超声成像系统被不断地微型化。2020年,Tanter团队利用微型化fUS系统,结合电生理系统,记录了清醒和自由活动大鼠在跑动过程中的大脑活动8,实验数据显示,在所有背侧海马亚区、脾后皮层和背侧丘脑中都发现了强烈的双侧激活,初级运动皮层在运动过程中表现出抑制,在奖励过程中表现出激活,这些区域的激活按照时间序列发生,不同区域之间存在延迟。此外,在同一次记录的早期和晚期之间,脑血流动力学发生了强烈的重塑,皮层区域的活动在10-20次跑动后迅速下降,而海马区域逐渐增强(图4)。
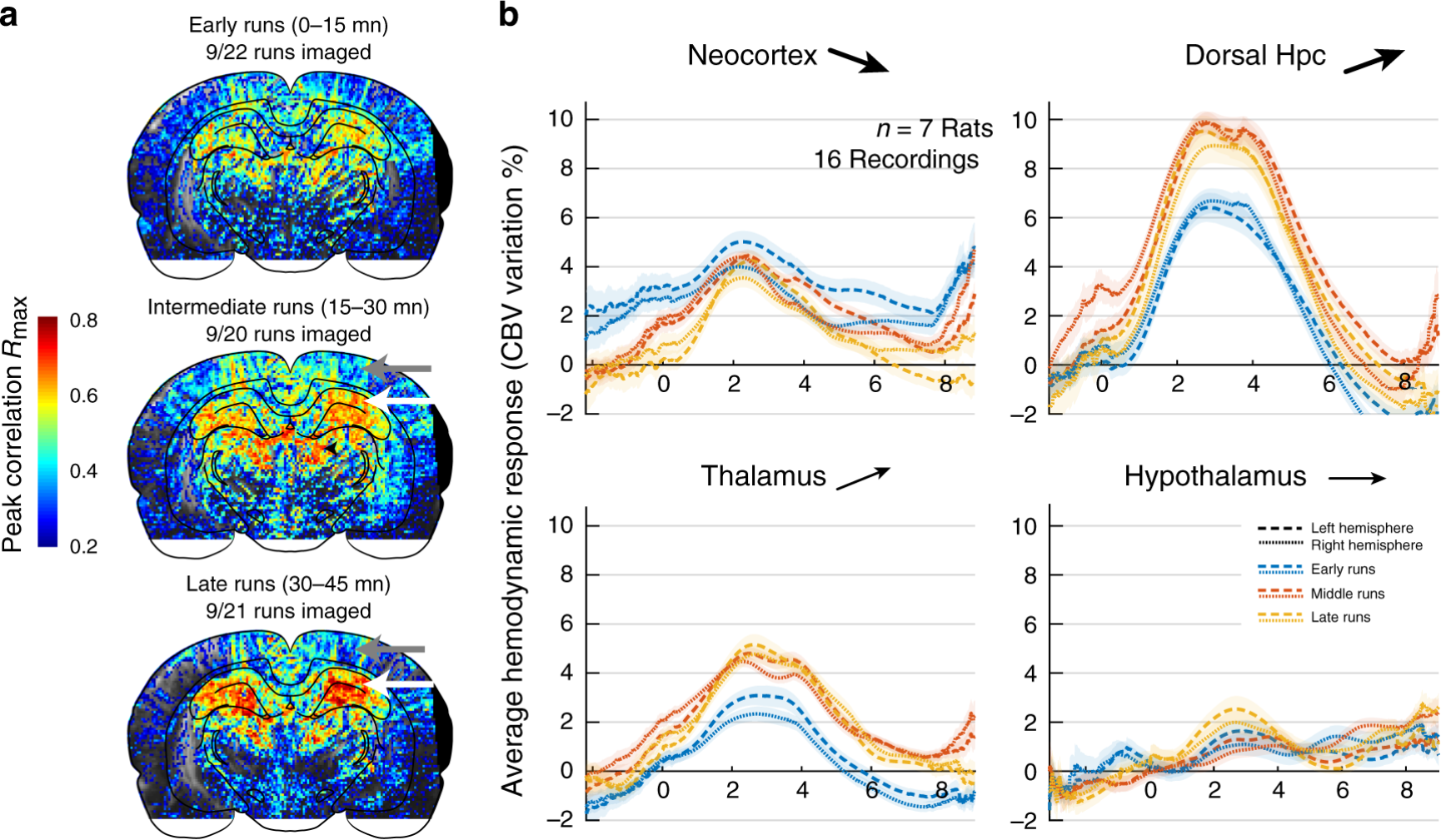
图4,试验不同时期的脑血流动力学表现出区域依赖性
同样利用微型化fUS,Tanter团队还研究了睡眠相关机制,他们发现,在大鼠自发的快速眼动睡眠(REMS)过程中,局部海马快速gamma节律先于全脑充血模式出现9。
fUS还可以应用于脑机接口(BMI)的研究。Tanter团队与加州理工大学的团队合作,针对非人类灵长类动物,使用fUS从后顶叶皮层上方的硬脑膜外记录脑血容量的变化,对运动意图进行单次试验的解码10,并在最近实现了闭环BMI11,在训练后,猴子可以使用超声BMI控制多达八个运动方向。
- 使用微气泡的超声定位显微镜可实现脑血管的超分辨率成像。
2015年,Tanter团队提出一种用于深度超分辨率血管成像的超快超声定位显微镜(uULM)12,用以获得更高的分辨率,其工作原理和荧光光激活定位显微镜 (FPALM)类似。将造影剂(直径为1-3 μm的微气泡)静脉注射到血管中后,由于微气泡远小于波长(1-3 μm),并且可以在时空上单独分离,将其作为超声系统的点扩散函数(PSF),通过提取微气泡质心的空间坐标,从而对成像结构进行重建。图5展示了Bregma -1.5 mm的冠状切面上,通过磨薄的颅骨进行uULM重建的结果,深度向和轴向分辨率分别为10×8 μm。与传统超声成像相比,uULM的分辨率提高了10倍。此外,其还具备3D重建能力,可通过3D uULM对大鼠的冠状动脉微循环进行评估13。
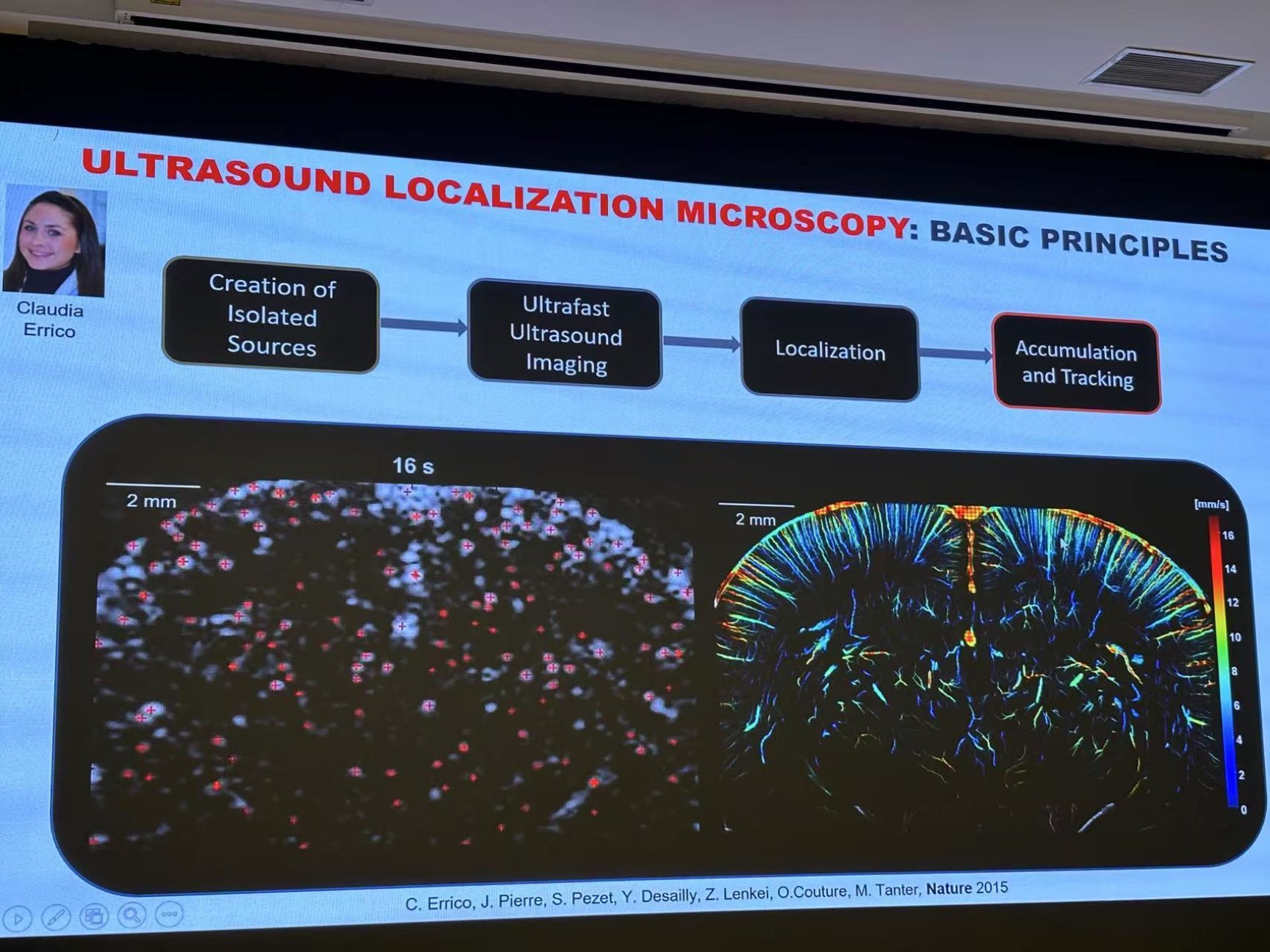
图5,大鼠大脑通过磨薄的颅骨的 uULM成像
但ULM也有其局限,在很小的血管中检测一个微泡往往需要很长时间,因此重复实验是必须的,将多次数据综合求得平均结果,稀疏数据就会变得越来越连续。在使用fULM记录大鼠胡须刺激任务的范式中,使用时间滑动窗口(通常为5秒,步长为1秒)来构建动态图像,最终在大鼠大脑的深部区域达到6.5 μm的空间分辨率和1秒的时间分辨率14。
最近,Tanter团队还将其应用在病人身上,对病人快速注射微气泡,在二十多秒的成像后,可以构建出对应血管的矢量血流图,在这里真正测量的是速度这一参量。相比于CT的结果,超声测量的分辨率更高,并且可以量化。
- 声遗传学利用超声激活基因修饰的神经元,是一种无创的神经调节技术,有望用于盲人的视觉恢复。
除了应用超声“读取”大脑活动外,利用超声“写入”大脑也是可能的,这要归功于最新的声遗传学概念。声遗传学与光遗传学类似,不同的是使用超声敏感通道(如MscL),而不是使用通道视紫红质或类似物。
2023年,Tanter团队报道,将MscL通过腺病毒相关载体(AAV)特异性的靶向递送到视网膜或初级视觉皮层,目标区域对15 MHz 频率下的US激活存在强烈而持续的响应,并且具有至少400 μm的空间分辨率和短于10 ms的延迟15。为了确定US引发的表达MscL的兴奋性皮层神经元的同步激活是否可以诱导光感知,Tanter团队还评估了表达MscL的小鼠在闪光-舔水联想学习测试期间的行为。相比于闪光刺激,US刺激导致的第一次预期舔水的潜伏期更短,声压越高,成功率也越高,在舔水奖励之前的500毫秒内,舔食频率也相应增加。这些结果表明,声刺激视觉皮层在小鼠体内产生的感知可能与视觉感知有关,但需要更复杂的视觉行为(如形态辨别)才能证明。
Tanter教授及其合作团队目标是帮助盲人患者的视觉恢复,如今,他们正在尝试利用超声阵列让灵长类动物识别字母。
参考文献
1. Tanter, M., Bercoff, J., Sandrin, L. & Fink, M. Ultrafast compound imaging for 2-D motion vector estimation: application to transient elastography. IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control 49, 1363–1374 (2002).
2. Sandrin, L., Tanter, M., Catheline, S. & Fink, M. Shear modulus imaging with 2-D transient elastography. IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control 49, 426–435 (2002).
3. Ultrafast compound doppler imaging: providing full blood flow characterization | IEEE Journals & Magazine | IEEE Xplore. https://ieeexplore.ieee.org/document/5688407.
4. Macé, E. et al. Functional ultrasound imaging of the brain. Nat Methods 8, 662–664 (2011).
5. 3D functional ultrasound imaging of the cerebral visual system in rodents. NeuroImage 149, 267–274 (2017).
6. Réaux-Le-Goazigo, A. et al. Ultrasound localization microscopy and functional ultrasound imaging reveal atypical features of the trigeminal ganglion vasculature. Commun Biol 5, 1–11 (2022).
7. Ferrier, J., Tiran, E., Deffieux, T., Tanter, M. & Lenkei, Z. Functional imaging evidence for task-induced deactivation and disconnection of a major default mode network hub in the mouse brain. Proceedings of the National Academy of Sciences 117, 15270–15280 (2020).
8. Bergel, A. et al. Adaptive modulation of brain hemodynamics across stereotyped running episodes. Nat Commun 11, 6193 (2020).
9. Bergel, A., Deffieux, T., Demené, C., Tanter, M. & Cohen, I. Local hippocampal fast gamma rhythms precede brain-wide hyperemic patterns during spontaneous rodent REM sleep. Nat Commun 9, 5364 (2018).
10. Single-trial decoding of movement intentions using functional ultrasound neuroimaging. Neuron 109, 1554-1566.e4 (2021).
11. Griggs, W. S. et al. Decoding motor plans using a closed-loop ultrasonic brain–machine interface. Nat Neurosci 27, 196–207 (2024).
12. Errico, C. et al. Ultrafast ultrasound localization microscopy for deep super-resolution vascular imaging. Nature 527, 499–502 (2015).
13. Coronary Flow Assessment Using 3-Dimensional Ultrafast Ultrasound Localization Microscopy. JACC: Cardiovascular Imaging 15, 1193–1208 (2022).
14. Renaudin, N. et al. Functional ultrasound localization microscopy reveals brain-wide neurovascular activity on a microscopic scale. Nat Methods 19, 1004–1012 (2022).
15. Cadoni, S. et al. Ectopic expression of a mechanosensitive channel confers spatiotemporal resolution to ultrasound stimulations of neurons for visual restoration. Nat. Nanotechnol. 18, 667–676 (2023).