Elizabeth Phelps:Mechanism of Threat Control and Translation Challenges
2021年11月6至7日,北京大学IDG麦戈文脑科学研究所成立十周年庆典暨北京大学脑科学国际论坛成功举办。来自美国哈佛大学、斯坦福大学、加州大学伯克利分校、英国伦敦大学学院、德国马普研究所、日本筑波大学、北京师范大学、中科院脑智卓越创新中心等国内外高校和科研机构的知名学者,从分子、细胞、环路、系统、认知、心理、计算、神经精神疾病等多个层面和角度,热情分享了他们在脑科学前沿研究的最新进展,并与线上线下观众频繁互动,在思维的碰撞中激荡出创新的火花。现陆续推出相关学术笔记,让我们重温精彩再出发!
本期推出的学术笔记,根据哈佛大学(Harvard University)Elizabeth Phelps教授,所作的题为“Mechanism of Threat Control and Translation Challenges”的学术报告整理而成。
Elizabeth Phelps教授作学术报告并与嘉宾观众交流
撰稿:李滢萱
审核:苗成林
摘要
利用动物模型,我们可以找到创伤治疗(threat control)的方法,以及其背后的机制。但是,如何将动物模型上的成果转换到人类模型上,是目前需要探索的问题。目前常用的创伤治疗的手段有遗忘(extinction)以及感情控制(emotion control)。利用动物模型,我们可以知道这两种手段均与利用了PFC脑区。但是在临床中,随着时间增长,病人往往出现病情反复的症状。而Elizabeth A. Phelps团队通过“躲避学习(avoidance learning)”“新奇遗忘(novelty facilitate learning)”,以及“强化更新(reconsolidate updating)”等手段,进一步控制PFC,使得治疗手段得到大幅提高。
从抑郁症到老年痴呆,动物模型为人类疾病的治疗提供了莫大的帮助。但是,动物模型与真实疾病之间,有时也会有着不小的距离。Elizabeth Phelps教授在报告中讲述了在创伤治疗(threat control)方面,他们是如何借助动物模型,一步步走向疾病治疗的。
实验人员往往用条件恐惧(fear conditioning)的方式建立危机模型。动物在经历足底电击后,往往会对和足底电击相关的情景产生恐惧,表现为静止不动(freezing)、呼吸加重、激素水平升高等。而人类在经历疼痛刺激后,无论是自己经历还是通过观看他人遭受电击,也会产生类似的消极情绪。由此,我们得以利用动物模型,探究进行人类创伤治疗的方法。
创伤治疗背后的机制已经得到了一定的研究。目前应用于临床的创伤治疗手段主要有遗忘(extinction)以及感情控制(emotion control)。“遗忘”指的是将受刺激者反复暴露在遭受危机刺激的原始环境,多次训练后可以降低对原始环境的恐惧。目前认为遗忘是由于腹内侧前额叶皮层 (vmPFC) 脑区抑制杏仁核,进而减少恐惧感,同时海马不断输入新的记忆,使得原始的恐惧感渐渐被抑制。“感情控制”指的是自我输入正向感情,切断和负向情绪的关联。其背后的机制主要是通过背外侧前额叶皮层(dlPFC)进行主观控制,进而通过腹内侧前额叶皮层 (vmPFC) 抑制杏仁核表达恐惧。可以说,在创伤治疗机制的探究中,动物模型的建立功不可没。
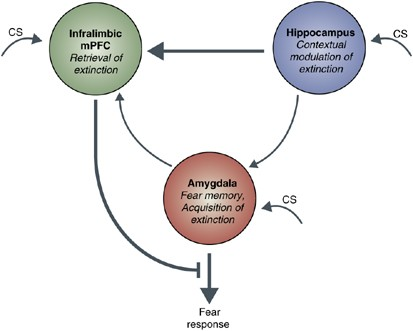
遗忘的神经机制 (Quirk & Mueller, 2008)
但是,无论是“遗忘”,还是“感情控制”,都可能会产生负向情绪的反复。那么,我们该如何利用新兴的技术,增强创伤治疗的效果呢?其中一种方法是提升遗忘的强度,以及增强vmPFC的抑制,另外一种方法是减少对vmPFC的抑制需求。
如何提升遗忘的强度呢?一种方法是让受胁迫者学会主动回避(avoidance)。在Boeke等人在2017年的实验中,他让两组人同时接受电刺激,之后,其中一组能够通过完成任务减少电击(也就是回避的过程),另外一组人只是被动的遗忘(extinction),结果发现在之后的测试中,被动遗忘组很多人都产生了回弹(relapse),而参与了avoidance的组回弹效应显著降低。利用动物模型,研究者们发现回避与由vmPFC到外侧杏仁核(lateral amygdala),再到基底核(basal nucleus),最后到达纹状体(striatum)的通路有关。
另外一种提升遗忘强度的方式是利用新事物(novelty facilitate extinction,NFE)。将经历过条件恐惧的被试分为两组,对照组只是经历简单的遗忘,也就是给予条件刺激但是不给予电击,而实验组经历了NFE的过程,在看到条件刺激时,同时可以听到新的声音,结果发现,一天之后,对照组依然会对条件刺激产生恐惧,而实验组基本不会产生,说明实验组能够比对照组有更好的遗忘效果。
但是,上述两种方法都需要通过vmPFC的抑制作为基础,但是vmPFC的抑制效果未必稳定,可能会随着压力或者一些病理学上的原因而难以形成。是否还有别的方法呢?
我们可以通过再巩固更新(reconsolidation updating)的方式进行遗忘,这种方法主要是可以减少对mPFC抑制的需求。在记忆之中,主要经历从学习到存储(巩固),之后提取的过程。而这个提取的过程所形成的记忆可以被重新记住,也就是重新巩固的过程。动物实验证明,如果在这个过程之中注射蛋白抑制剂,可以有效地促进遗忘。而在人类实验中,出于安全考虑,实验者们利用其它的方式进行验证。被试在第一天经历两组条件恐惧刺激,分别将橙色以及灰色的图片与电击相关联。第二天,被试会对橙色的图片进行reminder的过程,即不断看到橙色图片而不受到电击。接下来会对于橙色和灰色的图片均进行safety training。即通常的extinction过程。在此过程中,看到橙色图片,人们倾向于想到的是上一步的“安全记忆”,而对于灰色图片,人们倾向于想到的是曾经受过电击的记忆。因此,在第三天的测试之中,人们对于橙色图片的恐惧程度要显著低于对灰色图片的,形成了较好的遗忘效果。
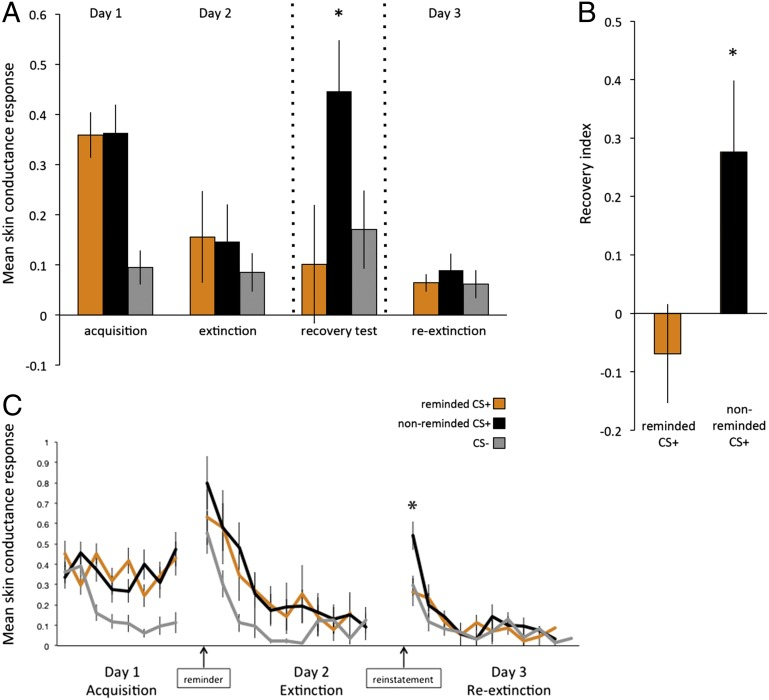
再巩固(reconsolidation)使得遗忘效果显著加强(Schiller, 2013)
这种再巩固更新的过程的神经机制是什么呢?这与PFC相关。通过对脑区活跃程度的检测,人们发现对于只进行简单遗忘的灰色图片,在遗忘过程中可以检测到vmPFC脑区的活跃,但是对于橙色图片,在遗忘过程中vmPFC的活跃程度处于较为平稳状态。
而在之前,“再巩固更新”理论一直没有很好地付诸实践。但在2017年的工作中,Maples-Keller等人利用这一理论治疗飞机恐惧。他们在进行暴露疗法之前,插入了一段“提示(reminder)”的过程,提示被治疗者高空飞行的情景。结果显示,经历这段治疗后,人们可以对高空飞行有更弱的生理恐惧反应(比如皮肤电导减小),但可惜这种治疗并没有减弱他们对高空飞行表现出的病理症状。
因此,如今在构建恐惧模型方面,我们可以较好地完成从实验动物到人类的转换。同时,我们也可以构建一些更加适用于人类的模型使得转换过程更加人性化。但是,如何将可以应用于实验动物的治疗方法应用于临床治疗,依然是需要解决的问题。