Eve Marder: Perturbations reveal that degenerate circuits hide cryptic individual variability
2021年11月6至7日,北京大学IDG麦戈文脑科学研究所成立十周年庆典暨北京大学脑科学国际论坛成功举办。来自美国哈佛大学、斯坦福大学、加州大学伯克利分校、英国伦敦大学学院、德国马普研究所、日本筑波大学、北京师范大学、中科院脑智卓越创新中心等国内外高校和科研机构的知名学者,从分子、细胞、环路、系统、认知、心理、计算、神经精神疾病等多个层面和角度,热情分享了他们在脑科学前沿研究的最新进展,并与线上线下观众频繁互动,在思维的碰撞中激荡出创新的火花。现陆续推出相关学术笔记,让我们重温精彩再出发!
本期推出的学术笔记,根据布兰迪斯大学(Brandeis University)美国科学院院士 Eve Marder,所作的题为“Perturbations reveal that degenerate circuits hide cryptic individual variability”的报告整理而成。

Eve Marder教授作报告并与嘉宾观众交流
撰稿:刘潇
审核:吴思
神经科学的一个基本问题是:如何从神经元及其相应突触连接都明确的神经网络出发,去理解其神经环路功能。Eve Marder团队特别感兴趣的科学问题是,相似的神经环路行为究竟可以由多少种神经环路机制产生。这种差别也许体现在不同的个体动物中,也许是在同一动物一生中的不同阶段。他们选择了甲壳动物口胃神经系统(crustacean stomatogastric nervous system)的中枢模式发生环路(central pattern generating circuits)作为研究对象。中枢模式发生器是脊椎动物和无脊椎动物神经系统都共有的一组负责产生特定节律行为,如行走、游泳和呼吸等的神经环路。其中,龙虾和螃蟹的口腹神经节(stomatogastric ganglion,STG)的中央模式发生器更是理想的实验和计算建模对象,因为它是一个由连接关系明确的30个大神经元构成的神经环路,其神经元易于记录,并且在离体后它仍可以继续产生有节律模式行为。
Eve Marder教授的报告主要从以下三个方面展开:首先,不同参数设置的神经环路产生怎样的神经活动;其次,在网络活动行为“正常”的条件下神经环路及其参数有多大的可变性;最后,神经环路如何去适应外界环境(如,温度,气压,神经调节剂等)的变化。
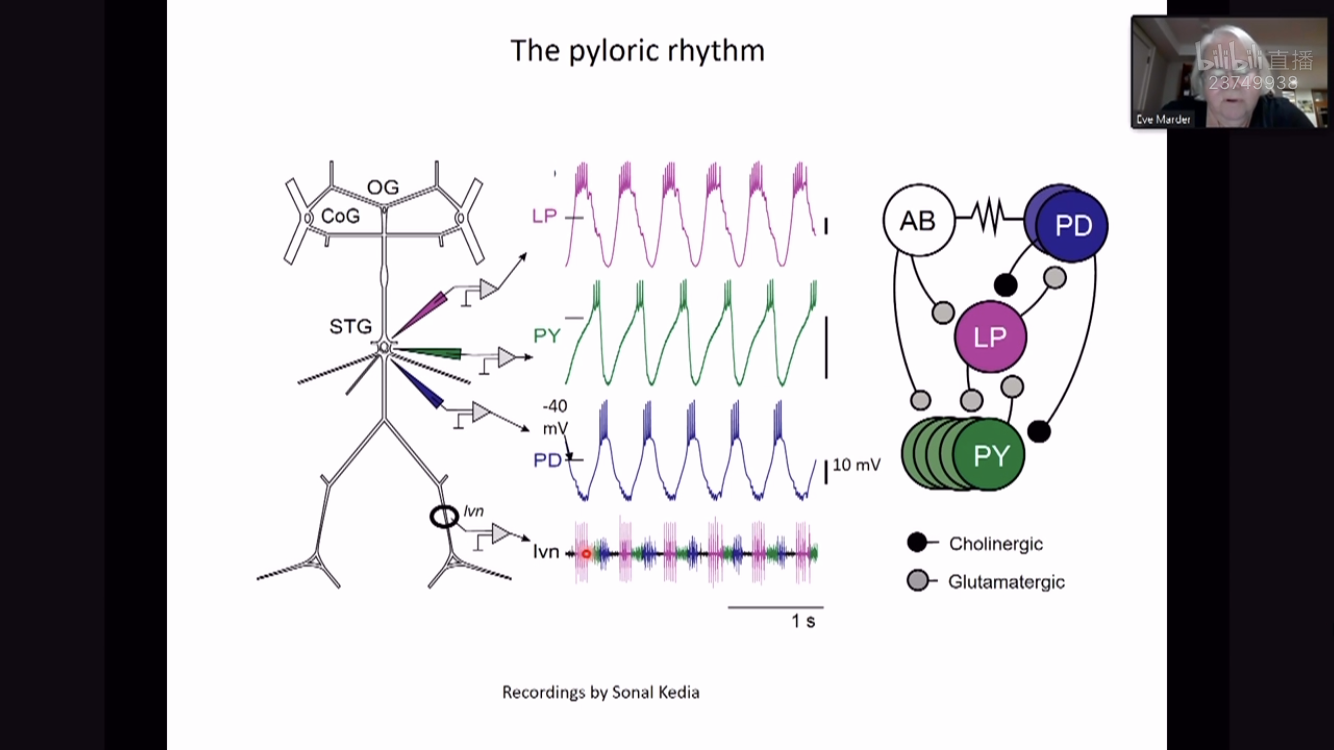
Figure 1 口腹神经节STG神经回路及其幽门节律示意图
尽管,STG系统相较于其他的神经模型已经是十分简单的了,但事实上,相似的节律行为可以由多种截然不同的神经环路内在机制产生。在Prinz等人2004年发表的工作【1】中,使用暴力搜索的方式,他们测试了STG理论模型中所有可能的突触强度和细胞特性的组合,结果发现在这两千多万中组合当中,有大约19%的网络模型都能够产生类似幽门节律的行为。随后Eve Marder团队根据所记录的99只龙虾STG系统中的幽门节律行为,定义了生物合理的幽门节律所具有的15个显著特征,包括神经元簇状发放周期的平均值和标准偏差、簇状发放的持续时间、开始、结束时间等。在这个更为严格的限制条件下,最终仍有2.4%的神经网络参数组合能够产生“真正的”幽门节律,并且这些神经网络模型的参数能够有几个数量级的差别。这意味着神经系统并不需要十分精细地设计每一处电导或连接权重,而是根据神经活动以及外界环境相应地作出适当调整,即可保证功能的稳定性。
另一方面,蛋白质的特性极其容易受温度影响,也就是说在不同的温度条件下STG系统中神经元离子通道可能会表现出完全不一样的特性。事实上,生物体中幽门节律的发放频率随温度升高而升高,但其特有的相位关系始终保持不变。为了能够更好地理解神经网络中这一动态变化的过程,Eve Marder教授通过每个电流的贡献百分比,并使用叠加面积图来显示它们随时间变化的过程,从而将神经元中离子动力学可视化【2】。如图2所示,当温度发生变化时,单个离子通道由于其上蛋白质特性的变化而变化,但整体是互相协调的,因此可以维持相似的节律特征,不会随着温度变化而改变。
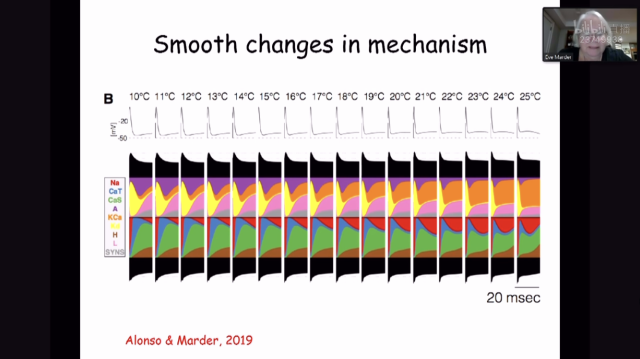
Figure 2 神经元离子动力学可视化,不同离子通道的贡献量随着温度平稳变化
然而,在极端的温度条件下,STG系统也会出现崩溃。不同参数条件的系统在正常范围内会有相似的节律行为,但当系统“崩溃”时,会出现截然不同的表现【3】。对于个体来说,这种在极端条件下展现出的不同的网络表现,可看作是对某些疾病的另一种理解。而从更广的种群层面来看,不同个体的恢复能力差异是群体生存的必要特性,表明神经行为本身可以由多种解决方案产生。这种差异也许在无压力的环境中很难被观测到,但是当这种改变达到影响神经网络行为时,其后果将无法预测。
Eve Marder教授通过实验和计算建模相结合的手段,对甲壳动物口腹神经节STG系统产生幽门节律的内在机制进行了系统地研究,揭示了神经回路通过多种内在机制相互协调,使得网络行为不需要严格的条件限制,且对于外界干扰具有较好的鲁棒性,但是,在极端条件下,网络行为则会因其内在机制的差异出现截然不同的反应。
参考文献
【1】 Prinz, A.A., D. Bucher, and E. Marder, Similar network activity from disparate circuit parameters. Nature Neuroscience, 2004. 7(12): p. 1345-1352.
【2】 Alonso, L.M. and E. Marder, Visualization of currents in neural models with similar behavior and different conductance densities. eLife, 2019. 8: p. e42722.
【3】 Alonso, L.M. and E. Marder, Temperature compensation in a small rhythmic circuit. eLife, 2020. 9: p. e55470.